JBは、社会課題である環境問題の解決のため「日本血液製剤協会カーボンニュートラル行動計画」に基づいて、2050年カーボンニュートラルに向けたビジョンの策定および目標の設定を行い、カーボンニュートラルの実現に向けて取り組みます。
JBは、国内および世界における血漿分画事業のリーダーとして事業を通じて社会に対して貢献し、環境保護に取り組んでいます。
国内外のすべての企業活動において、環境に与える影響を評価し、
継続的に環境負荷を低減します
はたらく人すべての安全への配慮を優先し、労働災害を防止します
環境安全活動において明確な目標を定め、
その達成のために効果的な推進体制を維持します
環境安全に関わる法規制遵守はもとより、社内外で取り決めた
さらに高いレベルの管理基準に基づいた活動を推進します
職員等(役員、正規職員、嘱託・パートおよび派遣)、一人ひとりの環境安全に対する意識を高めるため、計画的に教育・訓練を行います
環境安全に関する情報を積極的に開示し、社会とのコミュニケーションを深めます
地域社会の環境・防災活動に参画し、積極的に協力するとともに、
事故・災害などの不測の事態に備え対策を講じ、その影響を最小限にとどめます
千歳工場と京都工場では、環境安全に関するマネジメントシステムを構築し、環境保護と環境汚染の防止、職員の労働安全衛生の向上、火災やその他の災害への備え(防災)に努めています。
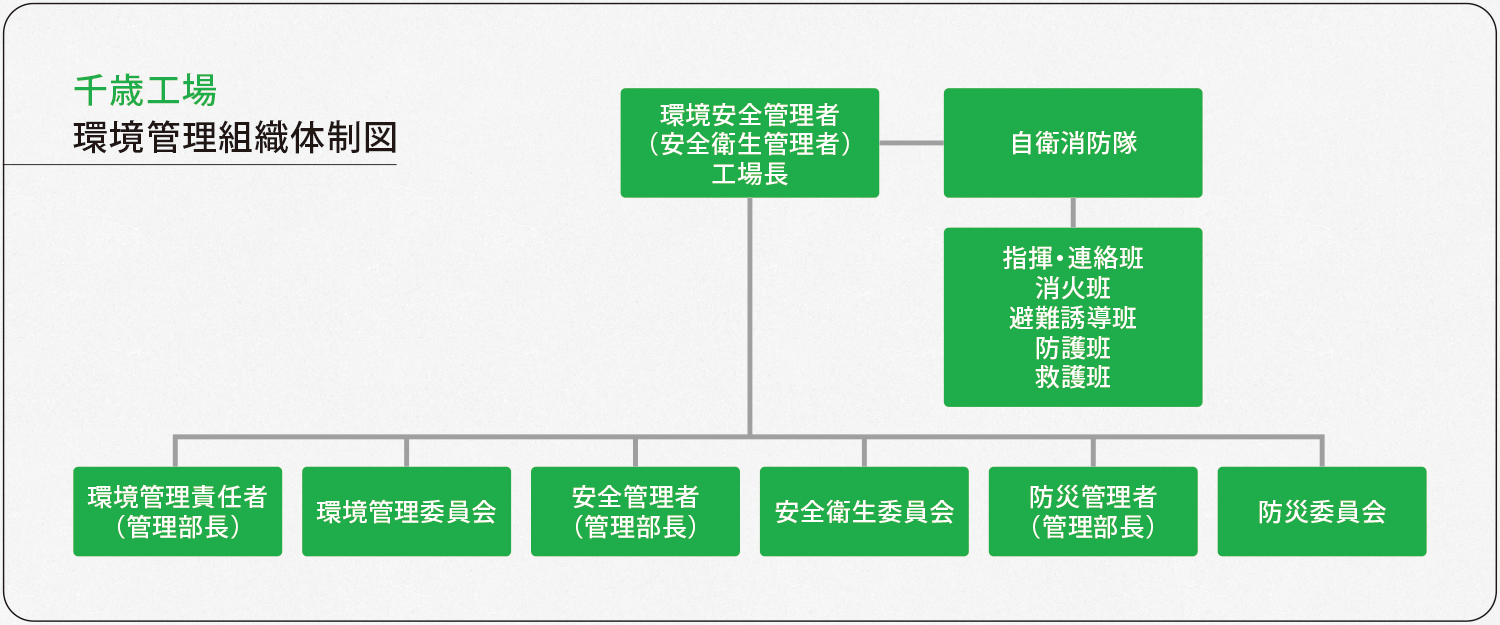
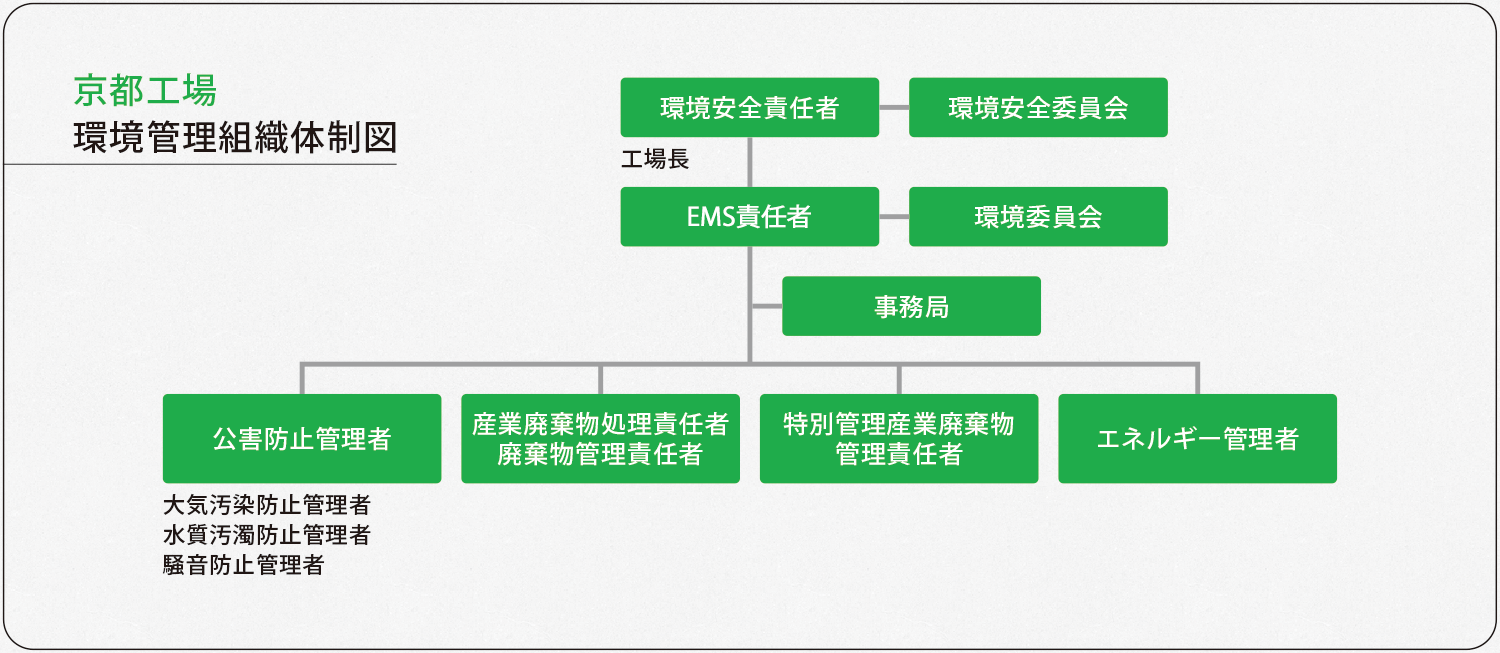
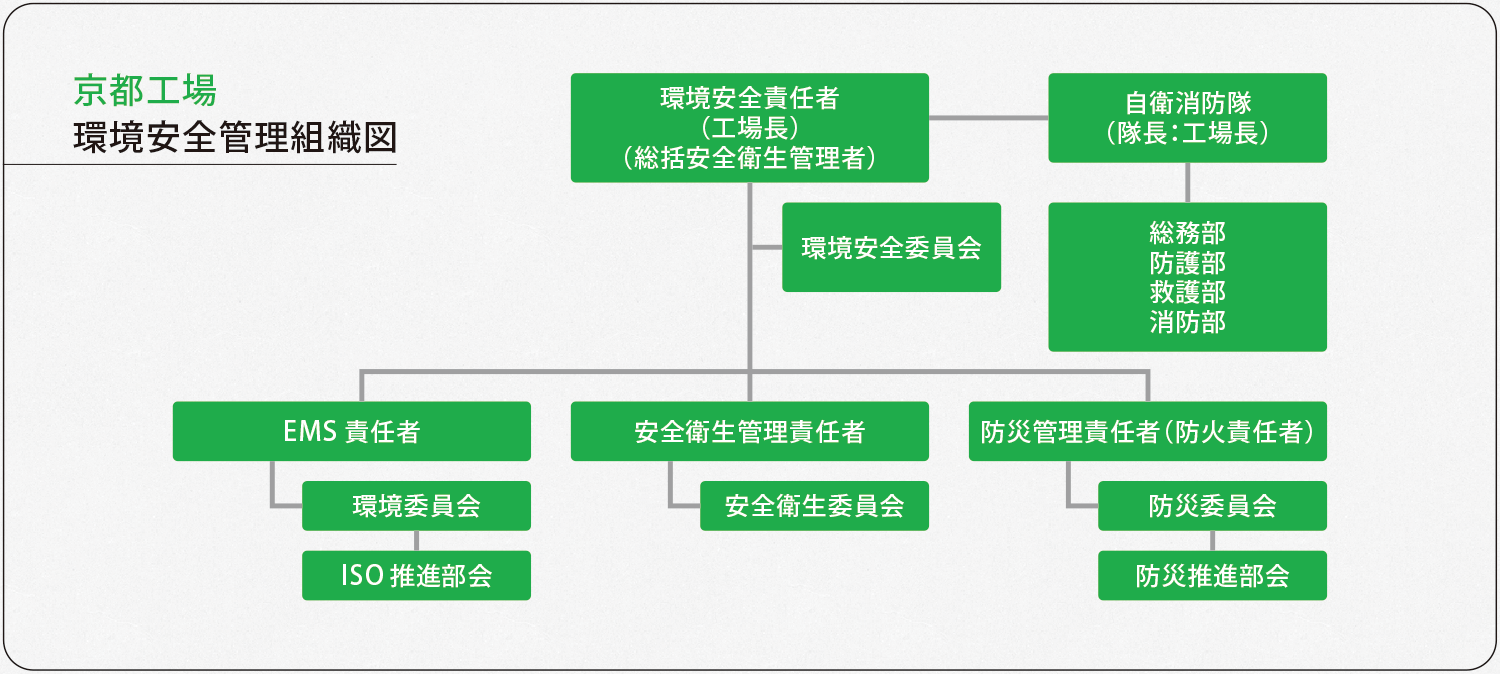
千歳工場と京都工場は、地球環境に配慮した医薬品製造所を目指すため、環境マネジメントシステムを構築、2000年10月に京都工場が、2005年12月には千歳工場がISO14001の認証を取得し、社会への貢献に努めています。(ホームページ、「環境への取り組み」をご参照ください。)
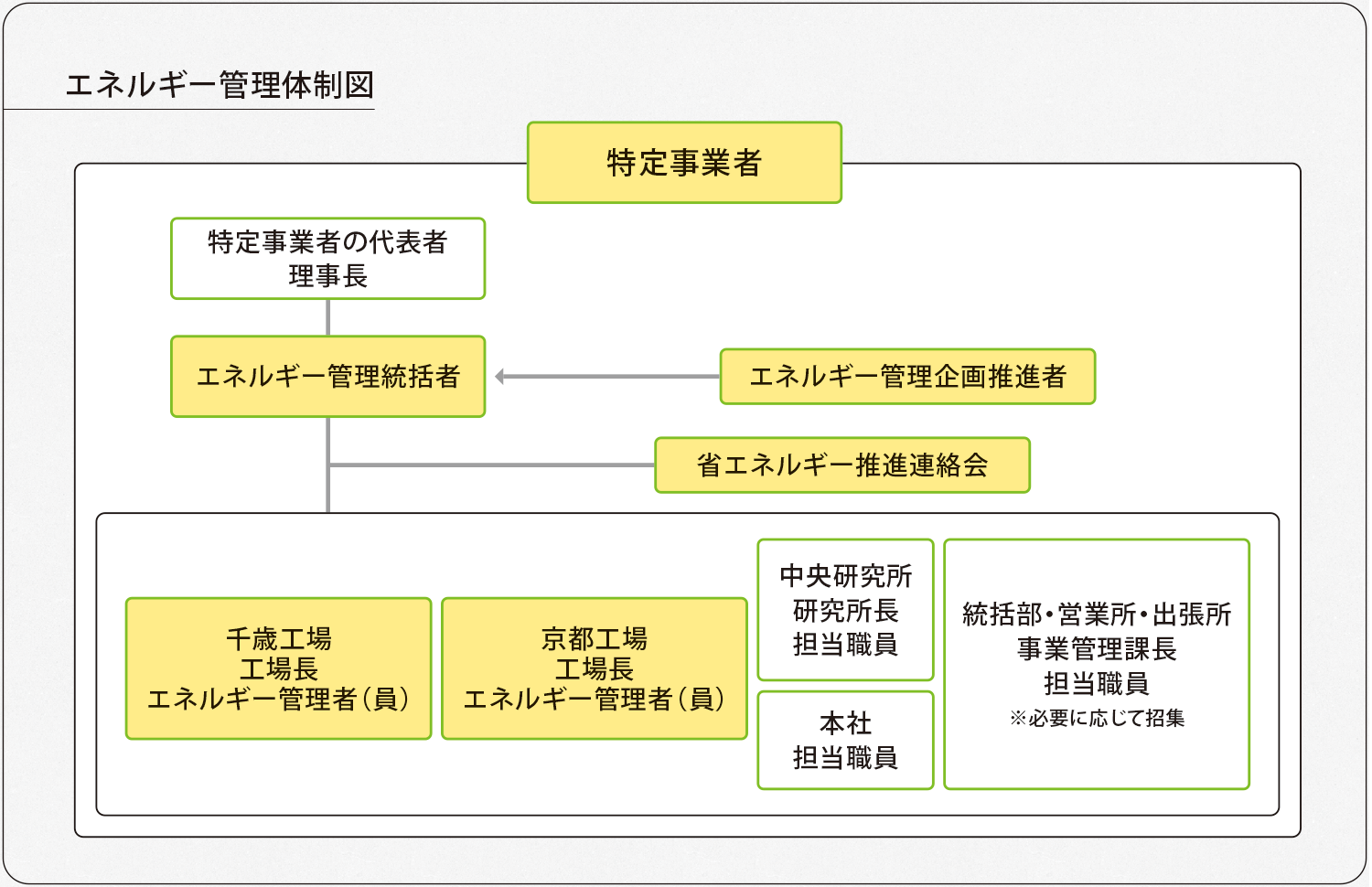
JBでは2022年11月、全社的な取り組みとして「SDGs/カーボンニュートラル」推進ワーキンググループを設置し、CO2排出量削減目標を2030年までに2013年度比-46%と定めました。その一環として、使用電力を段階的にカーボンニュートラル電力に切り替えることで、実質的なCO2排出量削減に取り組んでいます。
千歳工場は、「ゼロカーボンシティ宣言」を掲げる千歳市と連携し、CO2削減に取り組む千歳工業クラブの検討メンバーとしてこれに参画し、2024年10月には「ちとせゼロカーボンシンポジウム」も開催されました。工場内ではスチームトラップの劣化診断と不具合箇所更新による蒸気ロスの低減、空調設備の運転方法見直し、水素ボイラの導入検討等、多角的な省エネ対策を進めています。
また、京都工場においては、「関西エコオフィス宣言」および「中丹環境ネットワーク」へ登録し、各種省エネ活動や環境課題の解決に向けた積極的な活動に加え、環境提案による環境改善への取り組みや部署ごとにテーマを決めて、環境保護および環境への負荷の低減などを実施し、地球温暖化対策(または環境保護と環境汚染の防止)に取り組んでいます。この取り組みにより、京都工場は、2018年に京都府地球温暖化対策条例排出量削減計画の優良事業者として表彰を受けています。



JBでは営業活動においても環境に配慮した取り組みを行っています。MR(医薬情報担当者)が使用する営業車はハイブリッド車としているほか、カーボンオフセットが付帯された燃料を導入し、CO2の排出削減に努めています。
製品の配送においては、運送会社の皆さまにもご協力いただき環境に配慮された車両の使用やアイドリングストップの実施に努めています。
JBは、地球環境に配慮するため、廃棄物削減ならびに3R活動(Reduce:減らす、Reuse:繰り返し、Recycle:再資源化する)に取り組んでいます。千歳工場では、年間200t以上の廃棄物が排出されますが、3R活動を踏まえた積極的な取り組みによりシュレッダーくずや、段ボール紙を中心に10t以上をリサイクルとして活用しております。加えて、飲用の缶やペットボトルなどは、提携会社の皆さまと協力し、適切に分別された後に100%回収されており、リサイクル率向上に貢献しております。
また、2024年10月にはリサイクル業者との金属くずの有価売却契約を締結し、同年11月には製造機器やフリーザー等約2,100kgの金属類を有価売却しました。これにより実質的な廃棄物の削減にも取り組んでいます。
京都工場では、年間800t以上の廃棄物が排出されるため、ISO14001やSDGs/CN推進ワーキンググループ活動を通じて環境負荷を低減させる取り組みを行っています。その具体事例として、廃棄物の分別の徹底による廃棄物削減および3R活動に取り組んでおり、BOD脱水汚泥は業者の皆さまへの引き渡し後に全量堆肥化されているほか、プラスチック容器類はRPF化による燃料としてリサイクルされています。また、色紙やシュレッダーくずは製紙会社の皆さまへ引き渡し後に再生紙としてリサイクルされています。廃棄物は、一度排出するとリサイクルを行っても廃棄物としてカウントされるので、有価物として売却することにより廃棄物としない取り組みを継続しています。
 段ボール
段ボール
 金属くず
金属くず
 廃プラ
廃プラ
「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(通称カルタヘナ法)」の遵守において、研究部門では委員会を設置し、従事する職員への教育訓練および安全に取り扱うための体制を整備しています。