- 特集
腎移植における抗体関連型拒絶反応の治療 -腎移植におけるAMR治療を考える- 講演2・QA


座長
日本赤十字社愛知医療センター 名古屋第二病院 第一移植外科部長 渡井 至彦 先生
プロフィールを見る
【資格】日本泌尿器科学会専門医、日本泌尿器科学会指導医、日本臨床腎移植学会腎移植認定医 、日本泌尿器内視鏡学会 泌尿器腹腔鏡技術認定制度 認定医、日本内視鏡外科学会技術認定医(泌尿器腹腔鏡)、日本移植学会移植認定医
【所属学会】日本移植学会(理事, 代議員, 医療標準化・移植関連検査委員会 委員長、 感染症対策委員会 副委員長、レシピエント移植コーディネーター委員会 委員)、日本小児腎不全学会(評議員、監事、2016年会長)、日本臨床腎移植学会(評議員、理事)、 腎移植血管外科研究会(世話人、幹事、編集委員、2026年当番世話人)、日本泌尿器科学会、日本内視鏡外科学会、日本泌尿器科内視鏡・ロボティクス学会、日本透析医学会、国際小児移植学会 (International Pediatric Transplant Association)、アメリカ移植学会 (American Society of Transplantation Physician, International member)、一般社団法人TDM品質管理機構(理事)、公益財団法人愛知腎臓財団(専務理事)

講演1:腎移植後抗体関連拒絶反応とIVIgを用いた治療戦略
演者
東京女子医科大学病院 移植管理科・腎臓内科准教授 海上 耕平 先生
プロフィールを見る
【資格】東京女子医科大学 医学博士、日本内科学会 認定内科医・総合内科専門医、日本腎臓学会 専門医・認定指導医、日本透析医学会 専門医・指導医、日本臨床腎移植学会 認定医、日本移植学会 移植認定医
【所属学会】日本内科学会、日本腎臓学会、日本透析医学会、日本臨床腎移植学会、日本移植学会、日本小児腎不全学会、日本組織適合性学会、アジア移植学会

講演2:腎移植後抗体関連型拒絶反応における高用量IVIgの使い時を考える~適正使用に向けて~
演者
自治医科大学 腎泌尿器外科学講座 腎臓外科学部門教授 岩見 大基 先生
プロフィールを見る
【専門】腎移植・血管外科、腎代替療法、泌尿器腹腔鏡手術、泌尿器科全般、移植免疫学
【所属学会】日本泌尿器科学会(専門医、指導医)、日本泌尿器内視鏡・ロボティクス学会(腹腔鏡手術技術認定医)、日本移植学会(評議員、認定医)、日本臨床腎移植学会(理事、評議員、認定医)、日本内視鏡外科学会(技術認定医)、日本透析医学会、日本小児腎不全学会(評議員)、日本アフェレシス学会、日本組織適合性学会、腎移植・血管外科研究会(世話人)、アメリカ移植学会(American Society for Transplantation、AST)、国際移植学会(The Transplantation Society、TTS)、ヨーロッパ移植学会
(2026年2月当時のご所属)
講演2
腎移植後抗体関連型拒絶反応における高用量IVIgの使い時を考える ~適正使用に向けて~
自治医科大学 腎泌尿器外科学講座 腎臓外科学部門 教授 岩見大基 先生
※本文内に記載の薬剤をご使用の際には、電子添文をご参照ください。
※「警告・禁忌を含む注意事項等情報」等は、電子添文をご参照ください。
身体には、病原体に一度暴露されることにより免疫学的記憶を形成することで、二度目の暴露の際には抗体がより効果的、大量かつ早期に反応することを可能にするメカニズムが備わっている。このため妊娠・輸血・臓器移植既往と言った感作歴がある患者では、臓器移植時に抗体産生能が爆発的に反応し、産生された抗体により重篤な移植後抗体関連型拒絶反応(AMR)が引き起こされる。免疫学的記憶が備わるまでの反応として、まず抗原となる非自己HLAを認識したnaïve Bリンパ球が活性化する。B細胞より抗原提示を受けたTリンパ球によってさらなる活性化が促され、活性化Bリンパ球となり抗体を産生する1)。このような液性免疫獲得の収束後、Bリンパ球の一部は長期生存形質細胞(LLPC)あるいはメモリーBリンパ球(mBC)となって体内に残り、次の抗原暴露に備えるというのが免疫学的記憶のメカニズムである1)。mBCは比較的短期的な免疫反応に関与しており、普段はほぼ無活動であるが、次の抗原侵入に反応してIgMや親和性の低いIgGを産生する2)。それに対しLLPCは局在している骨髄から長期に渡って抗体を産生し、外来抗原の再侵入に備えて循環抗体量を一定に維持している3)。移植において、抗体産生の特性はLLPCとmBCの数的関係で説明できるのではないかと考えられる。
以上のようなことから移植前から存在するPreformed DSAは腎移植後早期のAMRに関連し、その治療効果は移植成績に直結するため4,5)、高感作症例ではAMRの回避・軽減を目的とした脱感作療法が行われる。
米国の22施設 1,025例の既存抗体陽性腎移植患者における脱感作療法後の腎移植の成績では、患者背景をマッチングさせた献腎移植または献腎待機患者と比較して患者生存率が優れていたことが報告されている6)。
また、韓国からの報告でも、HLA不適合の既存抗体陽性生体腎移植患者189例と、マッチングさせた対照群(献腎待機またはHLA適合献腎移植患者930例、献腎待機のみの患者930例)の比較において、脱感作療法(リツキシマブ、血漿交換、免疫グロブリン[IVIg]、ボルテゾミブ※1、およびタクロリムスを基盤とする維持免疫療法)を受けていた既存抗体陽性生体腎移植患者の生存率はいずれの対照群よりも有意に高く(p<0.001, Log rank検定)7)、脱感作療法後に腎移植を受けた患者は、脱感作を受けていない患者や透析を継続する患者に対し、利益を得られる可能性が示唆されている。※1本邦では適応外
当院では、IVIgが「腎移植における抗体関連型拒絶反応の治療」に対する適応を取得して以降、二重濾過血漿分離交換(DFPP)をIVIgの前に施行する形で脱感作プロトコールを組んでいる(図1)。
IVIgは、自然免疫から獲得免疫に至るまで幅広く多彩な作用機序を有するとされている。IVIgの作用機序に関する最近の知見として、母体から胎児へIgGを輸送して出生直後の免疫維持を担う受容体neonatal Fc receptor(FcRn)との関連が報告されている8)。FcRnは血管内皮細胞に発現して投与薬剤のクリアランスに関与している。IgGが細胞表面のFcRnに結合すると細胞内に取り込まれ、再び血中に遊離して半減期が延長する一方、FcRnと結合していない IgGは分解される。そのためIVIgを大量投与すると、IVIgとDSA(DSAも当然IgGである)によってFcRnが飽和状態となり、FcRnと結合できなかったDSAは相対的に分解されやすくなり、血中DSA量の減少に至るとされている。
【図1】自治医科大学 腎臓外科学部門でのDSA陽性(クロスマッチ陽性)患者に対する脱感作プロトコール
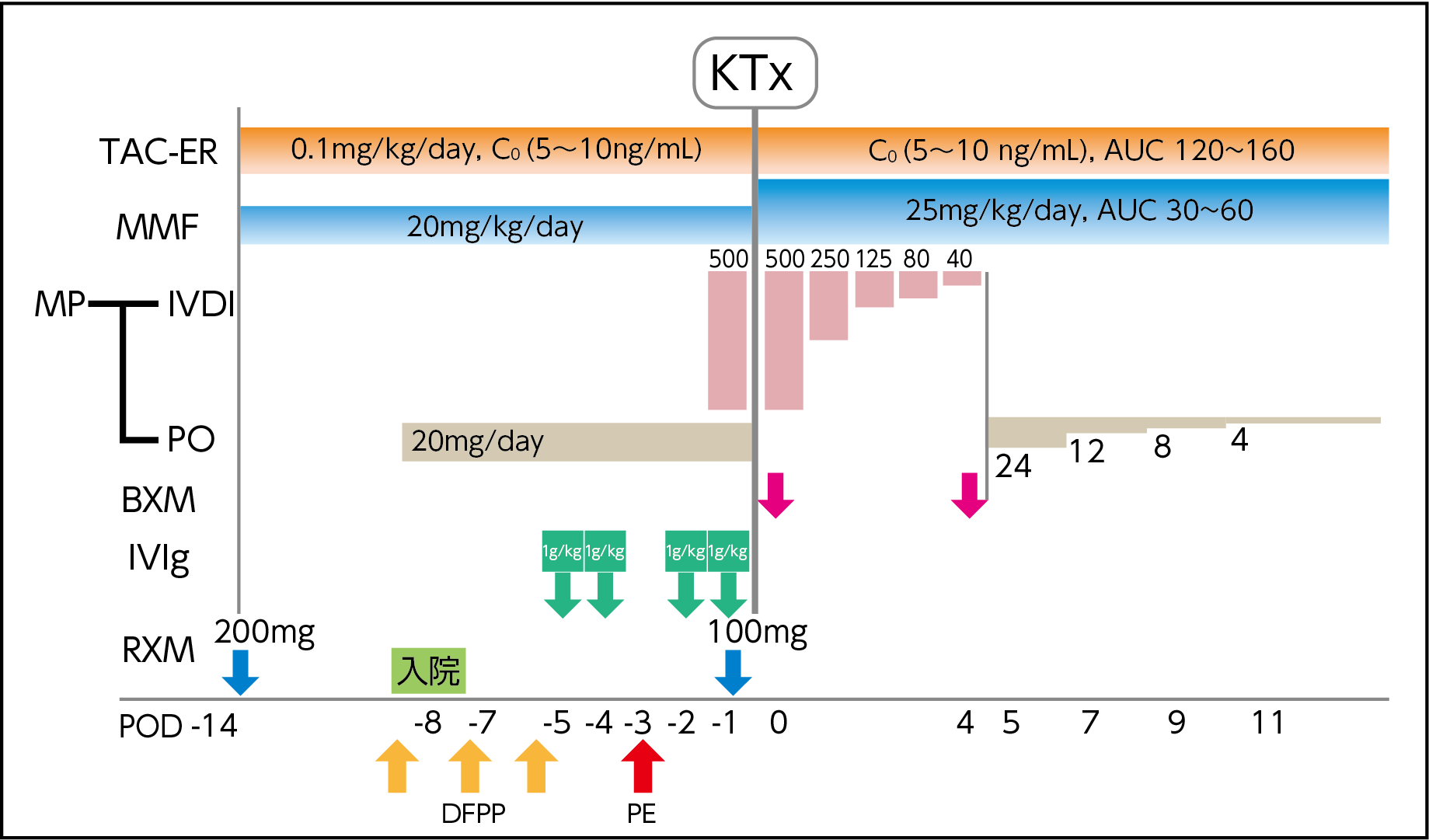
BXM:バシリキシマブ、DFPP:二重濾過血漿分離交換、IVDI:点滴静注、IVIg:免疫グロブリン、KTx:腎移植、MMF:ミコフェノール酸モフェチル、MP:メチルプレドニゾロン、PE:単純血漿交換、PO:経口投与、POD:post operative day、RXM:リツキシマブ、TAC-ER:タクロリムス徐放製剤
岩見大基先生ご提供
4. 効能又は効果
下記の臓器移植における抗体関連拒絶反応の治療
腎移植、肝移植、心移植、肺移植、膵移植、小腸移植
6. 用法及び用量
通常、人免疫グロブリンGとして、1日あたり1000mg(10mL)/kg体重を点滴静注する。
ただし、患者の年齢及び状態に応じて適宜減量する。なお、必要に応じて追加投与する。
7. 用法及び用量に関連する注意
7. 9 本剤は投与開始から10日間以内を目安に2回の投与を完了するが、患者の年齢及び状態に応じて適宜調整すること。
4. 効能又は効果
抗ドナー抗体陽性腎移植における術前脱感作
6. 用法及び用量
通常、人免疫グロブリンGとして、1日あたり1000mg(10mL)/kg体重を点滴静注する。
ただし、患者の年齢及び状態に応じて適宜減量する。なお、総投与量は4,000mg(40mL)/kg体重を超えないこと。
7. 用法及び用量に関連する注意
7. 8 本剤は投与開始から7日間以内を目安に投与を完了するが、患者の年齢及び状態に応じて適宜調節すること。
AMRは発症時期でみると、移植後30日以内とそれ以降に大別されることが多い9)。Preformed DSAによるAMRのうち、移植後30日以内に発症する移植後早期AMRは不十分な脱感作療法または脱感作療法の失敗を原因とし、トリガーとなる細胞群がmBCとされる。これに対し、移植後1~3ヵ月以降に発症するlate onset AMRは形質細胞に依存した抗体産生により発症し、病理ではactiveな所見はやや減少し、chronicなパターンをとることが比較的多い10)。一方、de novo DSA(dnDSA)によるAMRは、アドヒアランス不良や免疫抑制薬の減量といった免疫抑制不足が原因とされる10)(図2)。
【図2】AMRの発症様式とDSA・産生細胞の関係
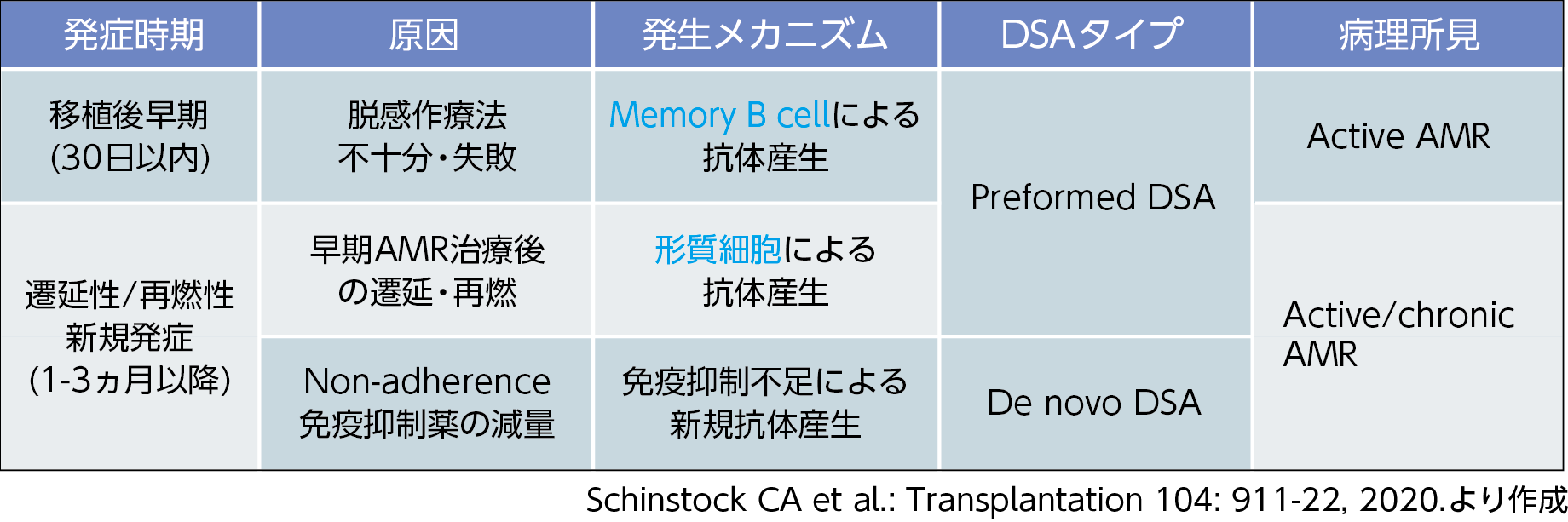
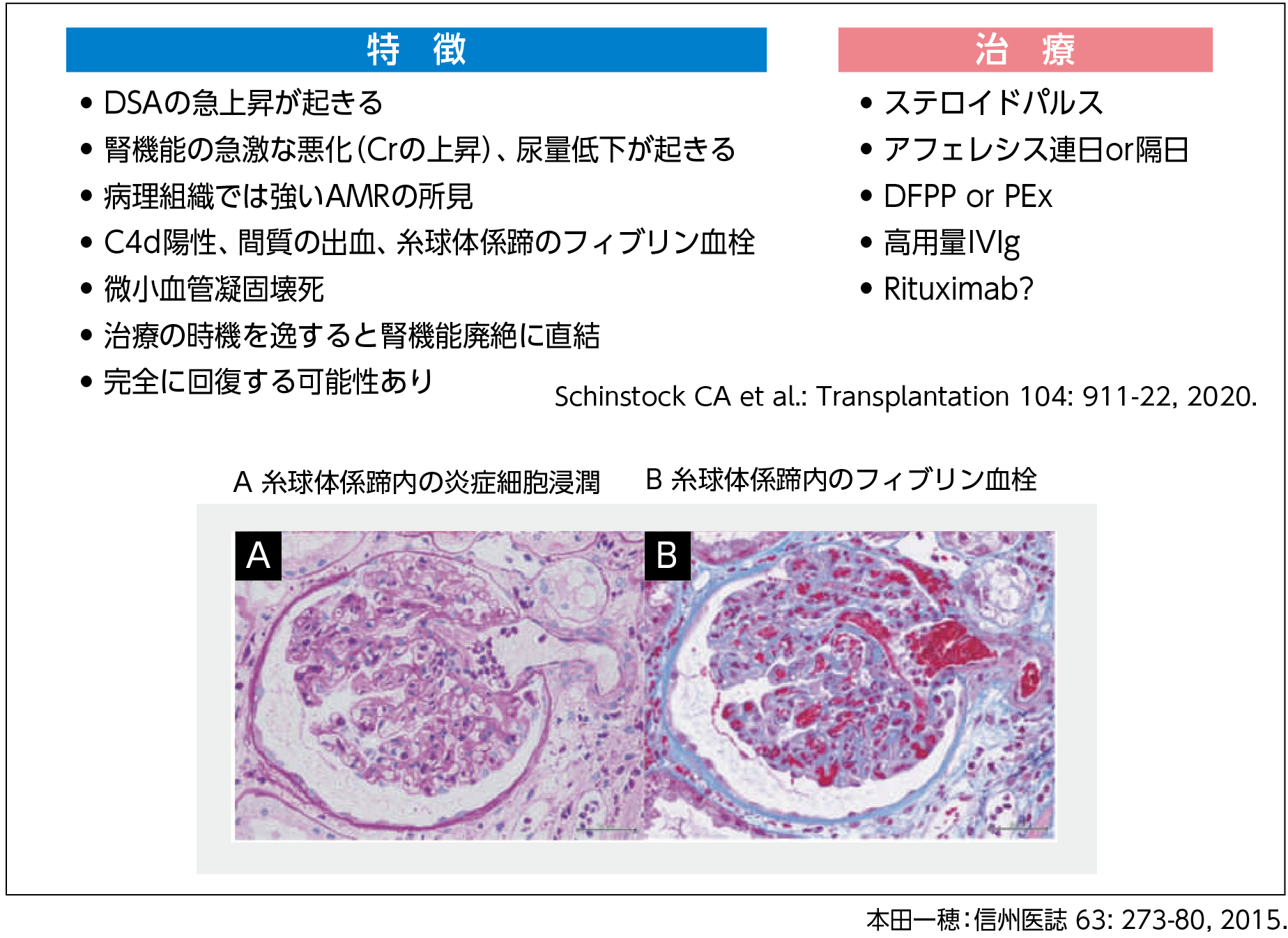
30日以内の移植後早期AMRは、数時間あるいは数日単位というように急激に発症し、activeな病理所見を呈することが特徴である10)。移植腎機能廃絶を回避する上では、時機を逸せず治療介入を行うこと、そして完全回復の可能性があることから、複数のモダリティによる十分な治療を行うことが重要である(図3)10,11)。
【図3】移植後早期(30日以内)のAMRの特徴と治療
24例のAMR発症献腎移植患者(そのうち3ヵ月以内に発症した早期AMRが21例)に対する治療効果を検討したフランスからの報告がある。血漿交換、IVIg、抗CD20抗体製剤(リツキシマブ)の併用群12例と、高用量IVIg単独群12例での比較において、3年後のグラフト生着率は併用群で有意に高く(91.7% vs 50%, p=0.02, Log rank検定)、DSAの平均蛍光強度(MFI)も併用群のみで有意に低下していた(p=0.02, student t検定)12)。ここから早期AMRへの治療介入は高い効果が期待できること、複数のモダリティによる治療が有用であることが示唆される。
また、フランスのもう一つの報告ではリツキシマブ単剤投与と複合治療の比較を行っている。移植後1年以内に発症したactive AMR症例全例に血漿交換、IVIg、ステロイドパルスを施行後、その後の長期観察期間において1回以上リツキシマブ単独投与を受けた27例(リツキシマブ群)と11例の対照群を比較した。結果、7年後のグラフト生着率は両群に有意差は認められなかった(p=0.91, Log-rank検定)13)。この結果からも、複数のモダリティによる治療の重要性がうかがわれる。
Late onset/chronic AMRは、移植後3ヵ月以降にdnDSAが出現し、尿量の低下などがなく無症状のためprotocol生検で発見されることも多く、病理所見ではC4d陰性も珍しくない10)。cg>0や進行性腎機能悪化などが予後不良因子となる(表1)10)
Late onset AMRに関しても、併用療法の有用性を検討した結果が報告されている。
移植後3ヵ月以降に発症したlate onset AMRを対象に、IVIg+ステロイドパルス(標準治療)群38例と、標準治療に加えてリツキシマブ併用群40例を比較した米国の単施設前向き観察研究では、1年後のグラフト廃絶率はリツキシマブを追加した群で有意に低かった(15% vs 32%, p=0.02, Studentのt検定)14)。
【表1】Late onset/chronic AMRの特徴と治療

また、米国の後ろ向き観察研究では、chronic active AMRと診断された123例において、IVIg+ステロイドパルスはグラフト廃絶のリスク低下に関与していた(HR 0.38, 95%CI 0.21-0.69, p=0.001, Cox比例ハザードモデル)。グラフト廃絶のリスク因子としてDSA量が多い、chronicity score、またCr>3、Up/Ucr > 1など残腎機能が少ないことが検出された15)。
一方、スペインで実施されたchronic AMR 25例のRCTでは、IVIg+リツキシマブ群13例とプラセボ群12例のいずれの群においても、1年後における有意なDSA低下や組織学的改善は認められず(いずれもp>0.05, Studentのt検定)16)、移植糸球体炎を伴うAMRに対する治療の難しさを示唆する結果であった。
以上の知見からはchronicな病態に移行する前の介入がポイントになると考えられる。ごく最近オーストラリアから報告されたRCTでは17)、IVIg投与に伴う拒絶反応の進行抑制を介した病態安定化についての検討もされており、今後さらなる知見の蓄積が期待される。
IVIg使用のタイミングについては、興味深いレター論文がある。IVIgと抗体製剤を近接したタイミングで投与すると、抗体のリサイクルを担うFcRnをIVIgが占有することによって、抗体製剤の分解が促進され、効果減弱につながるというものである18)。米国の腎移植待機中の末期腎不全患者8例を対象とした第Ⅰ相試験では、IVIg+tesidolumab(抗補体モノクローナル抗体製剤;日本未承認)併用群6例とtesidolumab単独群2例の比較において、併用群は単独群に比べて抗体製剤の暴露量が34%減少、クリアランスが63%増加、半減期が41%短縮し、補体系阻害持続時間は併用群2週間に対し、単独群で4週間であった19)。
これらの知見を踏まえ当院では、抗体製剤の効果増強を期待して、治療緊急性のないlate onset/chronic AMRに対しては、入院1ヵ月前あるいは1ヵ月後に抗体製剤であるリツキシマブの投与を行っている(図4)。
【図4】自治医科大学 腎移植外科部門でのlate onset/chronic AMRに対する治療プロトコール
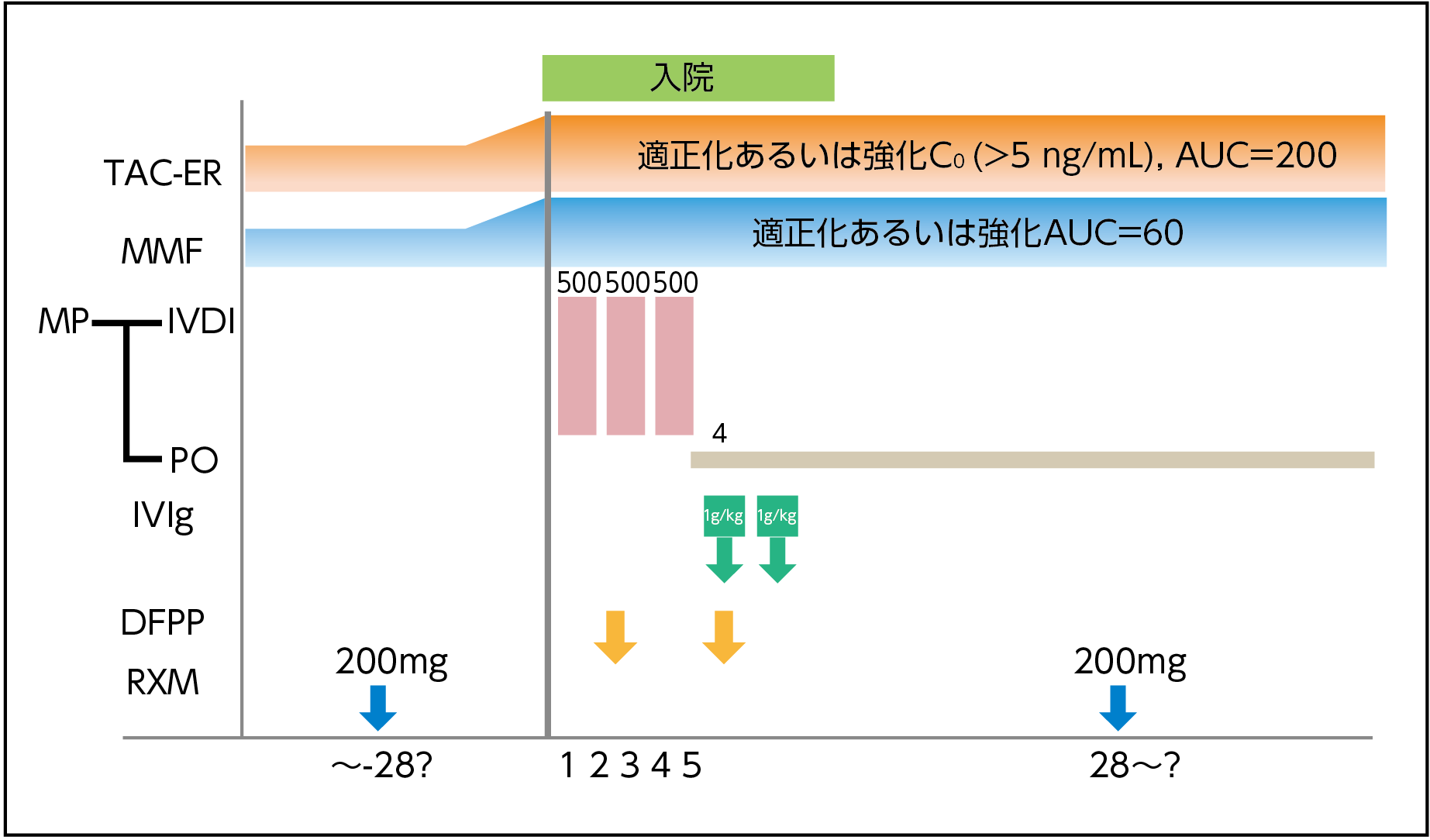
DFPP:二重濾過血漿分離交換、IVDI:点滴静注、IVIg:免疫グロブリン、MMF:ミコフェノール酸モフェチル、MP:メチルプレドニゾロン、PO:経口投与、RXM:リツキシマブ、TAC-ER:タクロリムス徐放製剤
岩見大基先生ご提供
総括すると、移植後早期のactive AMRに対しては、複数のモダリティを使用した十分な治療が重要であるといえる。また、chronic AMRに対しては、免疫抑制の適正化を目的としたアドヒアランス確認を必須として、治療法としては血漿交換、IVIg、リツキシマブの併用を検討すべきと考えている10)(表2)。
当院の高用量IVIgを用いた治療は、集学的なアプローチを基本として、残腎機能をある程度有している症例を対象に実施しているが、cg病変症例では効果減弱が認められる点に注意が必要である。また、抗体製剤併用時の投与タイミングについては今後の検討課題である(表3)。
以上のことから、移植後早期AMRに対しては、完全回復も視野に入れた十分な治療を行うことがポイントとなる。また、移植後中長期のchronic AMRでは、残腎機能・年齢・体力を考慮しながら、複数モダリティによる治療を行う必要がある。その一方で、医療資源の観点からはIVIgの適正使用にも努める必要があると考えている(表4)。
【表2】自治医科大学 岩見先生の考えるAMR治療
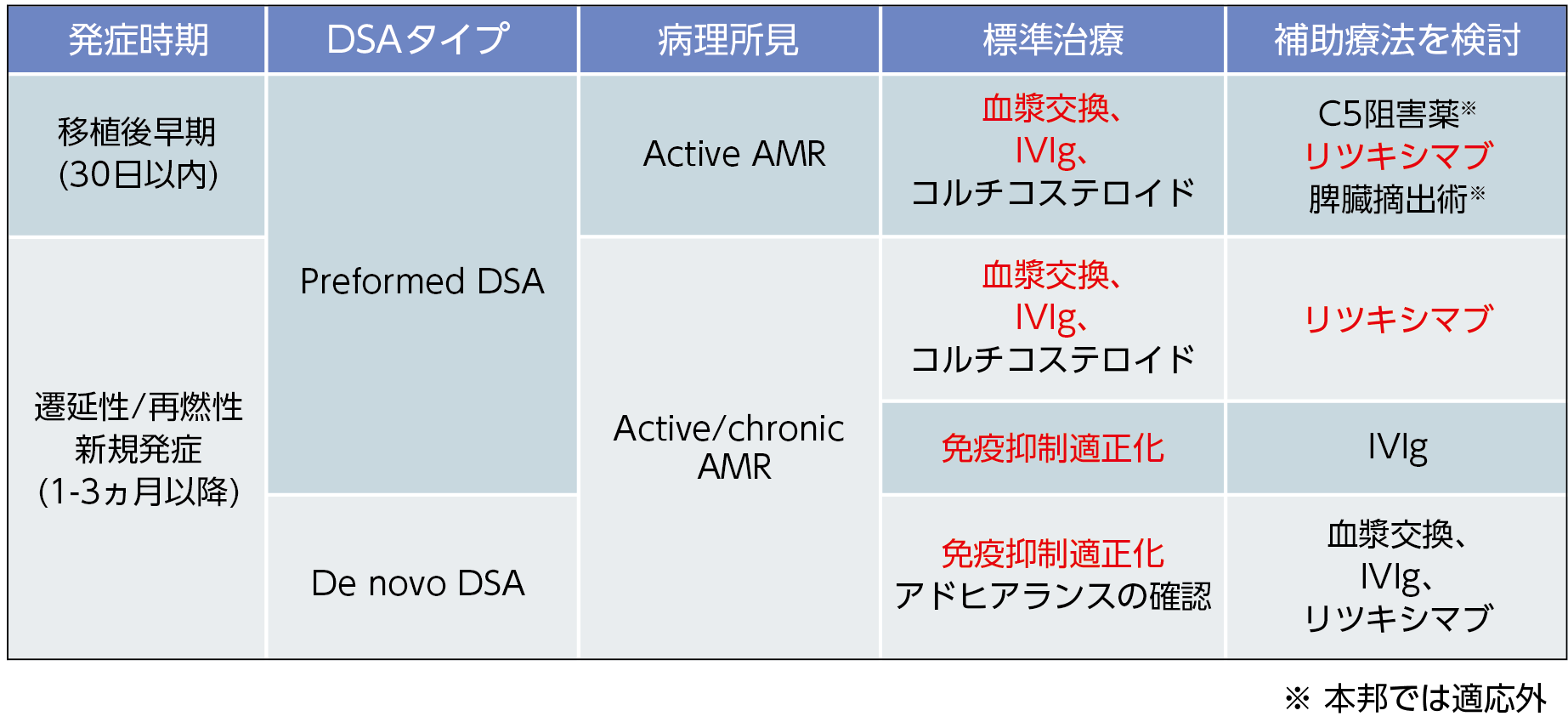
【表3】高用量IVIgを用いたAMRに対する治療

岩見大基先生ご提供
【表4】まとめ

岩見大基先生ご提供
【参考文献】
1) Bestard O et al.: Transpl Int 34: 1005-18, 2021.
2) Chong AS et al.: Transplantation 99: 21-8, 2015.
3) Noble J et al.: Transplantation 107: 351-60, 2023.
4) Bentall A et al.: Am J Transplant 13: 76-85, 2013.
5) Gloor JM et al.: Am J Transplant 10: 582-9, 2010.
6) Orandi BJ et al.: N Engl J Med 374: 940-50, 2016.
7) Koo TY et al.: Kidney Int 100: 206-14, 2021.
8) Berger M , J Peripher Nerv Syst 18:275-96, 2013.
9) Bertacchi M et al.: Clin Transplant 36: e14608, 2022.
10) Schinstock CA et al.: Transplantation 104: 911-22, 2020.
11) 本田一穂:信州医誌 63: 273-80, 2015.
12) Lefaucheur C et al.: Am J Transplant 9: 1099-107, 2009.
13) Bailly E et al.: Transpl Int 33: 786-95, 2020.
14) Parajuli S et al.: Transplant Direct 3: e227, 2017.
15) Redfield RR et al.: Hum Immunol 77: 346-52, 2016.
16) Moreso F et al.: Am J Transplant 18: 927-35, 2018.
17) Mulley WR et al.: Kidney Int 108: 470-80, 2025.
18) Reams V et al.: Transplantation 108: e69-e71, 2024.
19) Jordan SC et al.: Am J Transplant 20: 2581-8, 2020.
Q&Aセッション
AMRに対してIVIg 1g/kgを2回投与した後の追加投与についての考え方を教えてください
海上先生:当院では急性のAMRに対しては、IVIg投与から1ヵ月ないし2ヵ月後に、治療効果判定を目的とした腎生検を実施し、その結果に合わせて追加の投与量を調整しています。
渡井先生:腎生検の結果をみてということですが、IVIg追加投与の対象となるのは、奏効例、効果不十分例のいずれでしょうか。
海上先生:奏効例と病態が安定している症例はIVIg追加投与で効果が得られる可能性があります。ただし、chronicへの移行例では難しいのではないかと思います。gスコアやptcスコアが減少している症例に関しては、ステロイドパルス療法などが候補になるかもしれませんが、現時点では明確な基準はありません。
岩見先生:私も明確な答えは持っていませんが、病勢を見ることが大事です。移植直後早期の奏効例でもう一押しが必要であれば、追加投与の検討をします。ただし、医療資源の適正使用という面からは、腎機能の推移の確認と病理所見での判断が必要になります。
クレアチニン値が上昇を続ける慢性期の場合では生検のタイミングを3ヵ月~半年に早めることもありますが、検査値が安定している場合には1年後に再評価を行うなど、適宜評価の時期を決定しています。
渡井先生:評価としては腎生検が必要ということですね。
海上先生:はい。腎生検は侵襲的ではありますが、病勢の正確な評価には必要と感じています。
DSAと臨床症状のみでAMRと診断して、IVIgによる治療介入は行ってよいでしょうか
渡井先生:これに関してもやはり原則は腎生検ということになるでしょうか。
海上先生:腎生検は、その後の治療ストラテジーを立てる上でも必要です。DSA陽性でも拒絶がなかったケースもありますから、原則は腎生検はせざるを得ないと思います。今後は、セルフリーDNAなどのバイオマーカーの使用も考えています。
渡井先生:岩見先生はいかがでしょうか。
岩見先生:私もDSAが陽性でも病理所見が確認できない場合、基本的にはIVIgの使用に踏み切ることはしていません。逆に、一般的なDSA検査が陽性でなくても、病理所見は間違いないというケースが時にあるのですが、こういったケースは治療対象になります。
渡井先生:たとえば、DSAは陰性だが、MVIだけあるというような症例、すなわちBanff分類2022における「MVI, DSA negative and C4d negative」のケースも含めてということでしょうか。
岩見先生:はい、そういうことになります。
IVIgを用いたAMR治療にあたっては、ある程度の腎機能が残されていることが必要とのことですが、残腎機能を評価する具体的な指標があれば教えてください
岩見先生:eGFR 30以上、クレアチニン値3未満を一応の目安にしています。一般的に、eGFR 20~25であれば積極的な治療は行わないというところだと思います。
海上先生:岩見先生と同意見ですが、IVIgはボリューム負荷にもなるため、eGFRが低下して、蛋白尿も出ている方に対して高用量IVIgは使いづらいということはあると思います。
渡井先生:海上先生、岩見先生、ありがとうございました。
移植後のAMRに対する臨床研究はまだ始まったばかりということで、今後も症例を重ねて、またお話しいただく機会を作っていただければ幸いです。
開催日:2025年7月25日
会場:オンライン配信
主催:一般社団法人日本血液製剤機構
2026年2月掲載
審J2601236





