- 特集
腎移植における抗体関連型拒絶反応の治療-腎移植におけるAMR治療を考える-講演1


座長
日本赤十字社愛知医療センター 名古屋第二病院 第一移植外科部長 渡井 至彦 先生
プロフィールを見る
【資格】日本泌尿器科学会専門医、日本泌尿器科学会指導医、日本臨床腎移植学会腎移植認定医 、日本泌尿器内視鏡学会 泌尿器腹腔鏡技術認定制度 認定医、日本内視鏡外科学会技術認定医(泌尿器腹腔鏡)、日本移植学会移植認定医
【所属学会】日本移植学会(理事, 代議員, 医療標準化・移植関連検査委員会 委員長、 感染症対策委員会 副委員長、レシピエント移植コーディネーター委員会 委員)、日本小児腎不全学会(評議員、監事、2016年会長)、日本臨床腎移植学会(評議員、理事)、 腎移植血管外科研究会(世話人、幹事、編集委員、2026年当番世話人)、日本泌尿器科学会、日本内視鏡外科学会、日本泌尿器科内視鏡・ロボティクス学会、日本透析医学会、国際小児移植学会 (International Pediatric Transplant Association)、アメリカ移植学会 (American Society of Transplantation Physician, International member) 、一般社団法人TDM品質管理機構(理事)、公益財団法人愛知腎臓財団(専務理事)

講演1:腎移植後抗体関連拒絶反応とIVIgを用いた治療戦略
演者
東京女子医科大学病院 移植管理科・腎臓内科准教授 海上 耕平 先生
プロフィールを見る
【資格】東京女子医科大学 医学博士、日本内科学会 認定内科医・総合内科専門医、日本腎臓学会 専門医・認定指導医、日本透析医学会 専門医・指導医、日本臨床腎移植学会 認定医、日本移植学会 移植認定医
【所属学会】日本内科学会、日本腎臓学会、日本透析医学会、日本臨床腎移植学会、日本移植学会、日本小児腎不全学会、日本組織適合性学会、アジア移植学会

講演2:腎移植後抗体関連型拒絶反応における高用量IVIgの使い時を考える~適正使用に向けて~
演者
自治医科大学 腎泌尿器外科学講座 腎臓外科学部門教授 岩見 大基 先生
プロフィールを見る
【専門】腎移植・血管外科、腎代替療法、泌尿器腹腔鏡手術、泌尿器科全般、移植免疫学
【所属学会】日本泌尿器科学会(専門医、指導医)、日本泌尿器内視鏡・ロボティクス学会(腹腔鏡手術技術認定医)、日本移植学会(評議員、認定医)、日本臨床腎移植学会(理事、評議員、認定医)、日本内視鏡外科学会(技術認定医)、日本透析医学会、日本小児腎不全学会(評議員)、日本アフェレシス学会、日本組織適合性学会、腎移植・血管外科研究会(世話人)
アメリカ移植学会(American Society for Transplantation、AST)、国際移植学会(The Transplantation Society、TTS)、ヨーロッパ移植学会
(2026年2月当時のご所属)
講演1
腎移植後抗体関連拒絶反応とIVIgを用いた治療戦略
東京女子医科大学病院 移植管理科・腎臓内科 准教授 海上 耕平 先生
※本文内に記載の薬剤をご使用の際には、電子添文をご参照ください。
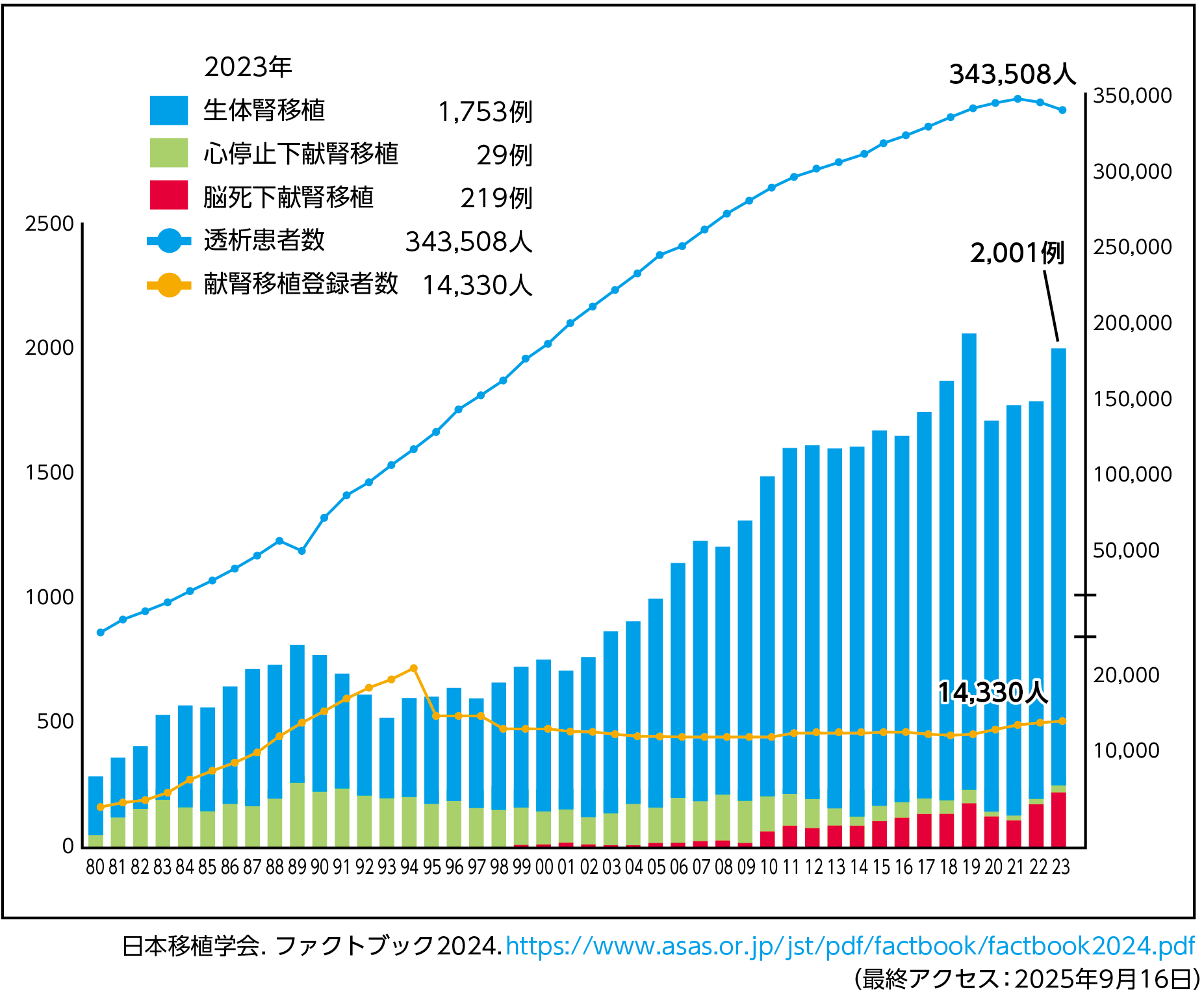
本邦における腎移植件数は年々増加し(図1)、5年生着率は生体腎では93.0%、献腎においても87.9%と良好な結果が得られている1)。こうした腎移植件数の増加や予後の長期化に伴い、累積の移植患者数も増加し続けている。
その背景には移植の適応拡大や移植成績の向上といった要因が挙げられ(表1)、なかでも抗ドナー特異抗体(DSA)陽性移植や夫婦間移植、そして多次移植といった移植免疫学的に高リスクな症例を扱う機会が増えている。
日本移植学会と日本臨床腎移植学会の最新報告(2024年版)によると、術前既存抗体検査でクロスマッチ(XM)陽性の腎移植が全国で一定数行われていることが分かる。補体依存性細胞傷害試験(Complement Dependent Cytotoxicity: CDC)陽性は数%と少ないものの、フローサイトメトリーXM陽性は約5~10%で実施されている。さらにDSA陽性にいたっては、2023年実施症例において、生体腎移植例の15.9%を占めており、本邦においてDSA陽性症例に対する腎移植は珍しくなくなってきている2)。
【図1】透析患者数・献腎待機患者数・腎移植数の推移
【表1】日本の腎移植の現状

これまでの腎移植後の長期追跡調査を実施した海外の研究3)では、グラフト廃絶率は、長期経過においてdeath with functioning graftよりも慢性拒絶反応が高くなり移植後10年時点におけるグラフト廃絶の原因の第1位は慢性拒絶反応であるとされている。さらに、腎移植後3~5年が経過すると、約3分の1にAMRが認められるという報告もある4)。
本邦においては、近年の腎移植レシピエントのおもな死因として、心疾患、感染症、悪性新生物が挙げられる2)。これに対して、グラフト廃絶原因は、慢性拒絶反応および急性拒絶反応は減ってきてはいるものの、それぞれ26.0%および6.5%であり2)、グラフト廃絶の30%程度と大多数を占めている。移植腎の長期生着という良い時代になってきているが、依然、拒絶反応が移植腎機能廃絶の主因となっている。
こうした現状を踏まえ、近年、日本移植学会を中心に拒絶反応の制御を目指した取り組みが進められている。その一つとして臓器移植抗体陽性診療ガイドライン2018年版5)から2023年版6)への改訂が挙げられる。さらに抗HLA抗体検査について、移植後検査は2018年時点で保険収載され、移植前検査も2020年に保険収載された。治療についても、献血ヴェノグロブリンIHに対し「抗ドナー抗体陽性腎移植における術前脱感作」が2019年、「臓器移植における抗体関連型拒絶反応の治療」が2024年に承認され、またリツキシマブによる脱感作・治療も保険収載されている。このように、さまざまな取り組みが段階的に行われた結果、DSA陽性症例への移植やAMR症例の治療が以前より取り組みやすくなってきている。
dnDSAのAMRはPreformed DSAによるAMRよりも治療抵抗性であることが知られている9)。出現率は報告により大きく異なり、移植後1年で約2~10%、4~5年で10~40%とされ、Wiebeらの報告において経年的な増加が示されている9, 10, 11)。また、平均出現時期も3.8~68ヵ月と、報告により異なる10, 12, 13)。10年前に検討された当院の成績では、移植後5年におけるdnDSA出現率は13%、平均発生時期は46.5ヵ月であった14)。
タクロリムスの濃度とdnDSAの関連性を検証することを目的とした、2000~2015年に当院で腎移植を施行した584例での検討15)において、164例にdnDSAを認め、出現率28.1%と前述の当院報告よりも高かった。さらに発生時期に関しても平均27.1ヵ月と過去の報告より短く、Wiebeらの報告と異なり移植後1~2年で増加した後は、次第にゆるやかな増加となった。さらにdnDSA発生群164例とdnDSA非発生群420例の比較では、dnDSA発生群では急性・慢性AMRともに有意に多く(いずれもp<0.001, χ2検定)、グラフト廃絶(p<0.001, χ2検定)も有意に多く認めた。dnDSA発生の要因解析では、リスク因子として、Preformed DSA陽性(p= 0.0001, χ2検定) およびHLA ミスマッチ数(p=0.0005, χ2検定)が、血中のタクロリムス濃度よりも有意な因子として示された。
すなわち、Preformed DSA陽性では、十分な脱感作を行わないとdnDSAが産生され、移植後拒絶反応や移植腎の生着に影響を与える可能性が示唆された。
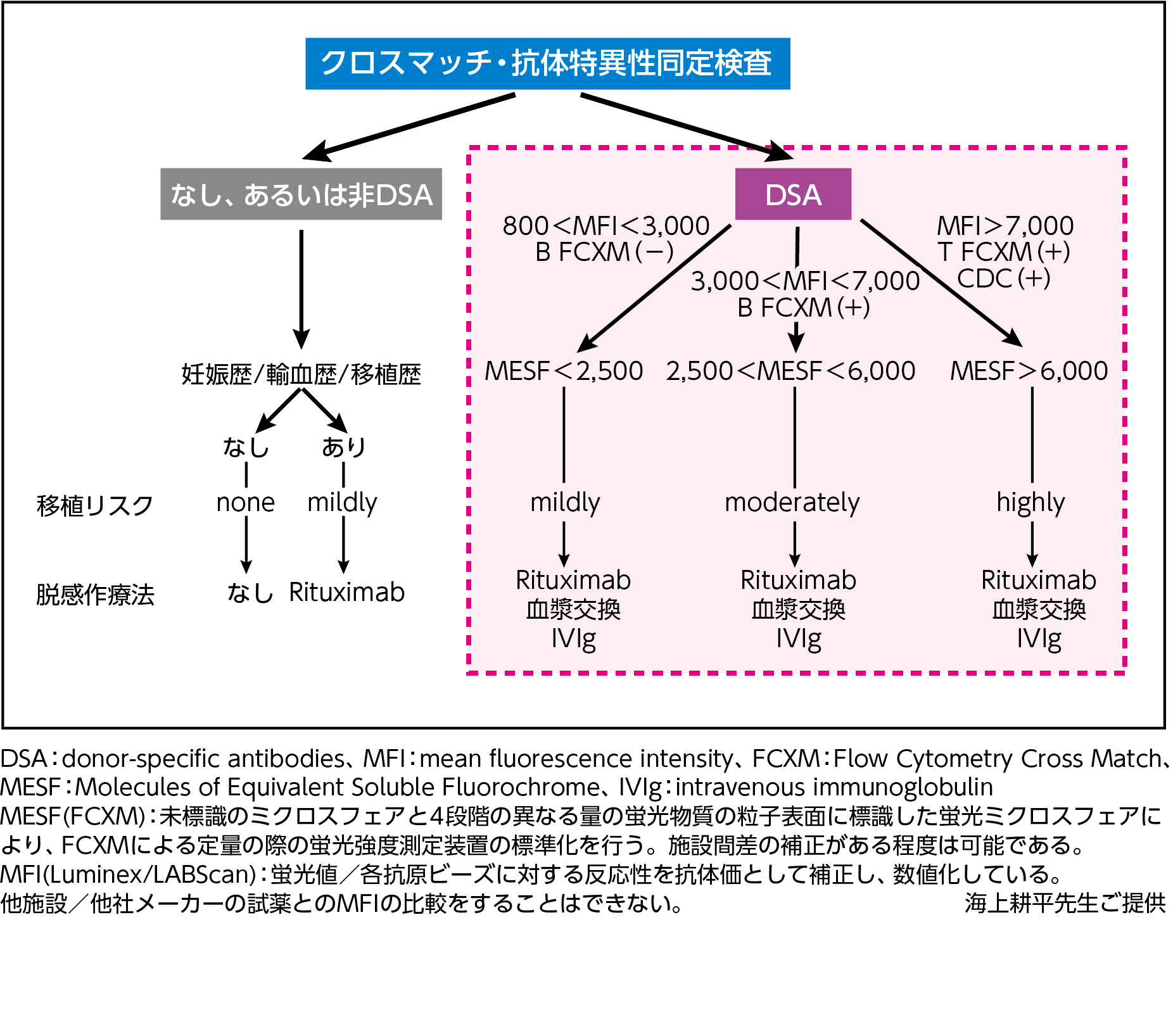
2014~2021年に当院で腎移植を実施した849例を対象とした当院の最近の報告16)では、移植後1年以内に59例に急性AMR発症を認めた。このうち51.9%の患者で慢性AMRへの移行を認め、慢性AMRへの進展リスク因子として、ドナーの年齢および微小血管炎症(MVI [g+ptc])が挙げられた。移植後AMRを来すと、その半数が慢性AMRへと進展する可能性があることに注意が必要である。こうした知見を踏まえ、当院においては2025年現在、術前の脱感作に関する選択に際しては免疫学的リスク分類を行い決定することとし、DSA弱陽性の群においても献血ヴェノグロブリンIHを使用した脱感作療法を行っている(図2)。 リツキシマブの使用量は軽度感作症例の場合、200mg/body を、中等度〜高感作症例の場合、500mg/body* を考慮する。血漿交換療法には単純血漿交換法(Plasma Exchange:PE)のほか二重膜濾過血漿交換法(Double Filtration Plasmapheresis:DFPP)を含む。また、DSA陰性症例の脱感作治療に関してリツキシマブは保険適用ではないことに注意が必要である(2025年12月現在)。
*記載の薬剤については承認外の内容が含まれておりますので、最新の電子化された添付文書をご参照ください。
【図2】東京女子医科大学 移植管理科における免疫抑制アルゴリズム
(2025年現在)
脱感作によりDSAを減少させ、AMR発症を抑制できることが複数報告されている17,18)。すなわち、Preformed DSA陽性症例に対して、血漿交換、IVIg、リツキシマブによる脱感作を施行することによりDSAの減少が得られ、良好なグラフト生着率や生存率につながる。このため、免疫学的リスクの十分な評価を行った上で適切な脱感作を行うことにより、Preformed DSA陽性症例での腎移植の施行が可能となると考えられる。
IVIgによる脱感作療法が保険収載される以前の当院の報告19)であるが、2012年から2015年に生体腎移植を受けた患者280例を、XM/DSA共陰性群229例、DSA単独陽性群36例、XM/DSA共陽性群15例の3群に分類し、XM/DSA共陽性15例にはIVIg、血漿交換、リツキシマブによる脱感作療法を施行した。その結果、移植後90日以内のAMR発症率は、XM/DSA共陰性群1.3%、DSA単独陽性群9.4%、XM/DSA共陽性群60.0%であった(p<0.001, Log-rank検定)。しかし、移植後4年時における腎機能や移植腎生着率に群間差は認めなかったことから、XM陽性症例を含めても脱感作療法の施行によって腎移植を行うことができ、移植腎機能に直結はしないもののAMRの発症率は高いことが示された。
さらにもう1つ、IVIg保険収載後の当院の報告20)として、免疫学的高感作症例(XM陽性±DSA陽性)15例にIVIg、リツキシマブ、血漿交換を含む脱感作を施行したところ、9例(60.0%)に拒絶反応が発現したものの、移植腎機能は保持されているという結果が示された。この検討では、高感作症例において腎移植は血液透析と比較して初期の医療費用は高額であるが、腎移植後、約3年で医療費が血液透析患者の医療費と同等程度となり、すなわち脱感作療法を必要とする免疫学的高感作の腎移植患者においても移植後良好な腎機能を維持することで、総医療費の抑制につながることが示唆されている20) 。
4. 効能又は効果
抗ドナー抗体陽性腎移植における術前脱感作
6. 用法及び用量 献血ヴェノグロブリンIH10%静注
通常、人免疫グロブリンGとして、1日あたり1000mg(10mL)/kg体重を点滴静注する。
ただし、患者の年齢及び状態に応じて適宜減量する。なお、総投与量は4,000mg(40mL)/kg体重を超えないこと。
7. 用法及び用量に関連する注意
7. 8 本剤は投与開始から7日間以内を目安に投与を完了するが、患者の年齢及び状態に応じて適宜調節すること。
8. 重要な基本的注意
8.15 大量投与に伴う水分不可を考慮し、適切な水分管理を行うこと。
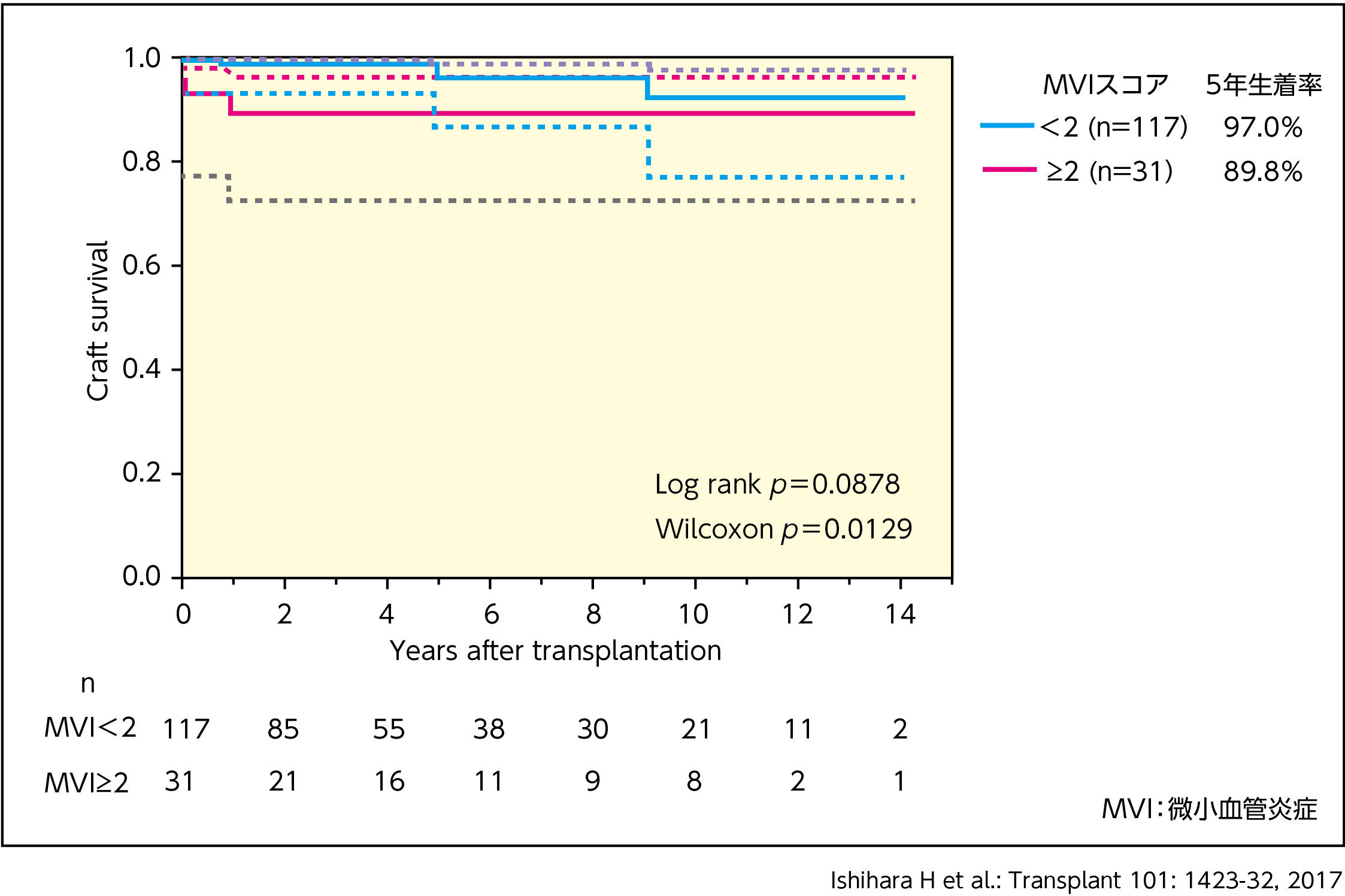
MVIの意義について述べる。当院の2017年の報告では21)、ABO不適合かつDSA陰性の症例において、MVIスコア(後述) 2以上の群はMVIスコア 2未満の群に比べ5年の腎生着率が有意に不良となることが示され(p=0.0129, Wilcoxon検定,図3)、MVIの高スコアは移植腎機能の増悪因子となると考えられた。
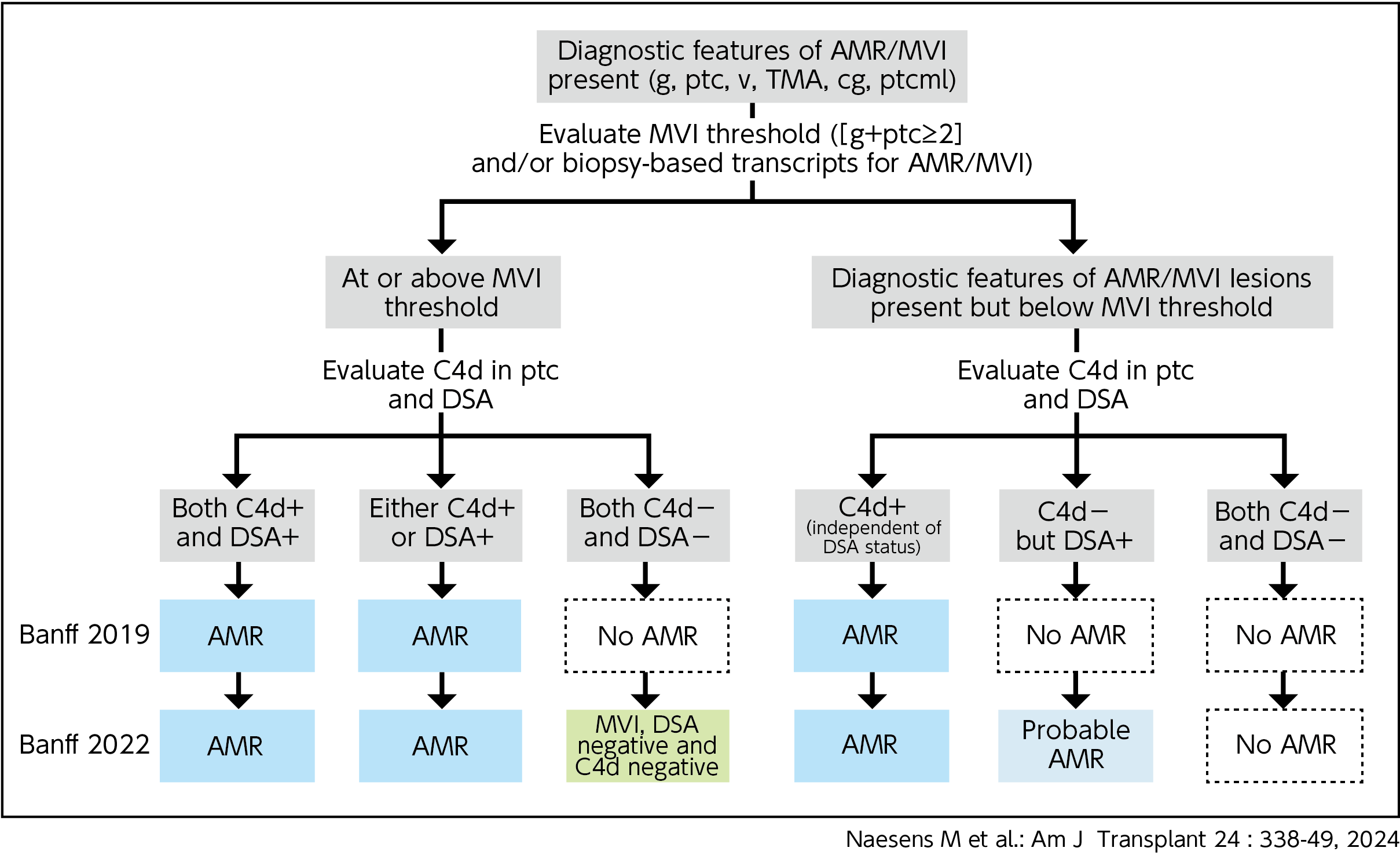
Banff分類2022年最新版22)では、Category 2において活動性AMR、慢性活動性AMR、慢性AMRなどのAMR分類がなされている(図4)。ここでまず重要となるのはAMRとMVIの関連である。MVIはg+ptcスコアで表され(糸球体炎[g]と傍尿細管毛細血管炎[ptc])、MVI陽性(g+ptcスコア2以上)はAMRの予見因子となり、移植腎機能に影響を与えると考えられている。
すなわち、2022年版以前のBanff分類と比べてまず大事なポイントとなるのがMVIであり、その存在はDSAが陰性であってもAMRに準ずるものと位置づけられる。
反対に、MVIが血中でどのような血清免疫学的異常を来すかを考えた際に、まず、DSA陽性の場合、C4d+、あるいはC4d-によりそれぞれ補体依存性細胞傷害活性(CDC)や抗体依存性細胞傷害活性(ADCC)が惹起され、AMRが引き起こされる。また、DSA陰性の場合にはAT1R抗体などのnon-HLA抗体が内皮細胞障害を来し、AMRを引き起こす可能性が考えられる。
このように、Banff分類の病理の図(図4)とMVIによりAMRが引き起こされる機序 が、お互いに補完していると理解できる。
【図3】MVIスコア≥2で層別化した患者におけるABO不適合腎グラフト生着率
【図4】Banff 2022分類カテゴリー2:AMR/MVIのフローチャート
AMRの治療について、1981~2017年の間に発表された研究のレビュー23)においてさまざまな治療戦略とともに、AMRの定義および治療のトレンドの変化が示されている。当初AMRは、ステロイド抵抗性のvascular rejectionとされ、抗体除去を目的として主に血漿交換が行われていた。2007年以降はBanff分類に基づきAMRと診断されるようになった。当時AMRの治療法に関するランダム化比較試験は抗体除去療法に対するもののみであり、その結果は、グラフト生着率に有意差は認められないというものであった(HR 0.76, 95% CI 0.35-1.63)。この時点では血漿交換やIVIg、リツキシマブについて十分な検討はできないとされていた。
AMRの治療に関しては、ガイドライン2018年版5)から2023年版6)への改訂までの間に次第に明らかになってきた。2023年版では、臓器共通として「ステロイドパルス療法単独やPE、高用量IVIg、ATGやリツキシマブ静注などを併用した治療が有効である。〈推奨グレード強 エビデンスレベルB〉ただし、確立したレジメンはない。」とされ、腎移植においては「抗体除去療法単独またはIVIg、リツキシマブを併用した治療が推奨されている。〈推奨グレード強 エビデンスレベルB〉」とされる。
AMRの治療には、①抗体産生経路とその関連細胞の阻害、②血中に存在するDSAの減少・消失、③DSAと血管内皮細胞の結合・反応性の抑制といったターゲットがあり、こうした抗体産生メカニズムに沿った治療薬の選択が重要と考えられる。各フェーズをターゲットとする薬剤は異なるが、IVIgは全フェーズにおいて有効であると考えられている24)。
慢性AMRとは、急性AMRに慢性所見、すなわちcg(糸球体毛細血管基底膜の二重化)、cv(動脈内皮線維化)、ptcml(傍尿細管毛細血管の基底膜の多層化)などの慢性炎症による変化が加わったものである。慢性AMRを対象にIVIgとリツキシマブの併用療法の有効性を検討した2018年の報告25)では、腎機能、尿蛋白、DSAのMFIの改善は認められなかったとされている。慢性AMRは治療奏効性が低い可能性を考慮し、慢性AMRに至る前の治療が重要となる。
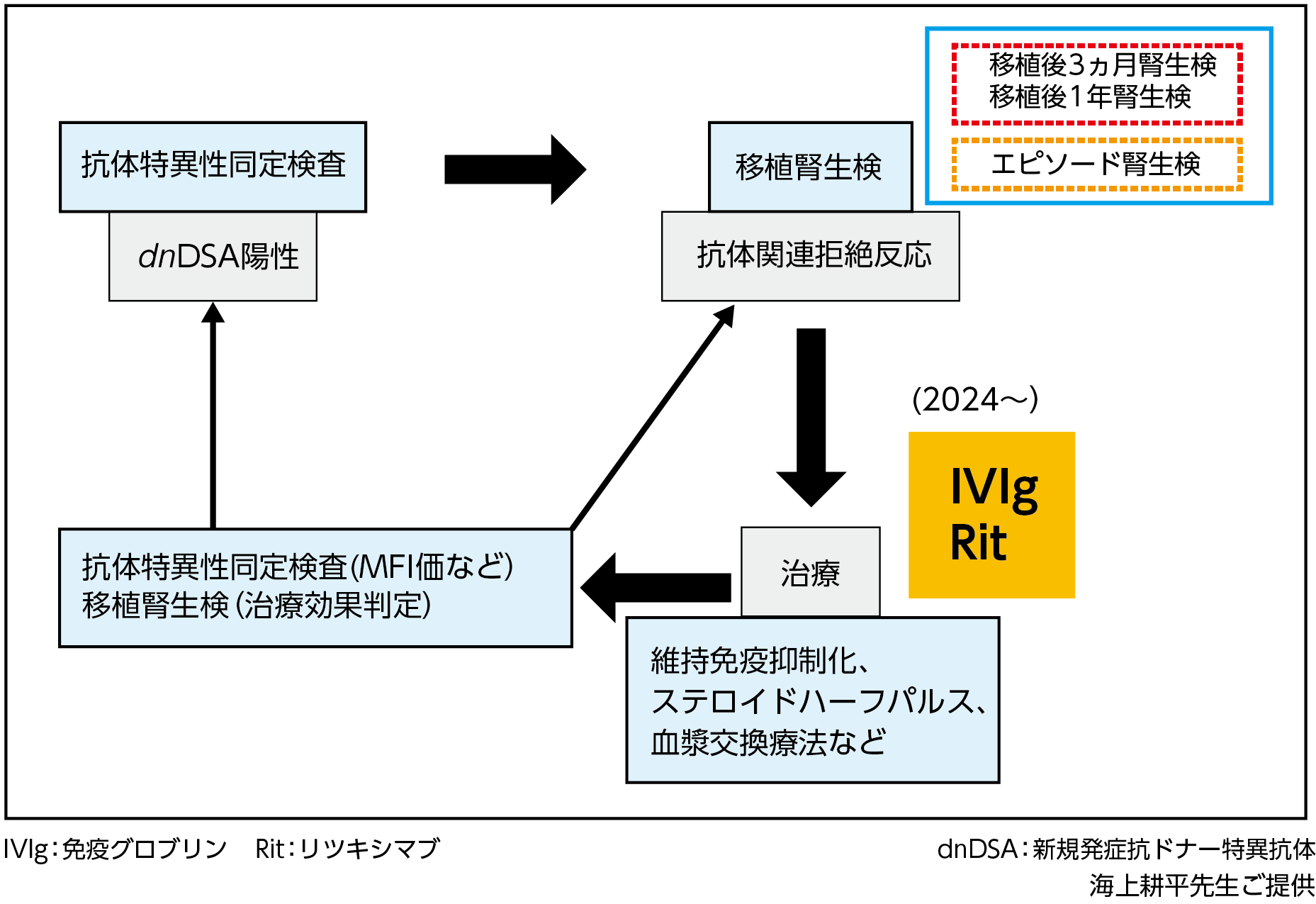
当院では、移植月に抗HLA抗体スクリーニング検査を施行し、陽性の場合には抗体特異性同定検査により dnDSA の有無の検索を行っている。dnDSA陽性症例では腎機能が安定していても移植腎生検を考慮し、拒絶反応の有無を確認している26)。なおプロトコール腎生検は移植後3ヵ月および1年で行い、DSA陽性の場合にはさらにエピソード腎生検を実施し、拒絶反応の有無を調べている(図5)。
前述の研究から15)、移植後1年時点で(dnDSA発生症例のうち)約40~50%の症例でdnDSAが認められており、移植後3ヵ月および1年で腎生検と併せることで早期にAMRやMVIなどを検知することが可能になる。さらに前述のようにMVIないし急性AMRは慢性AMRのリスクとなるため、当院の治療戦略は、慢性活動性AMRおよび慢性AMRに至る前の治療に繋がるものと考えている。このように当院ではdnDSAやAMRの早期発見と治療介入を重視している。
【図5】東京女子医科大学 移植管理科におけるdnDSA陽性時の治療戦略
紹介した症例は臨床症例の一部を紹介したもので、全ての症例が同様な結果を示すわけではありません。
当院で腎移植後AMRに対してIVIg治療を行った症例を提示する。
50歳代の女性。末期腎不全の原疾患は糖尿病性腎症。妊娠歴や輸血歴を有する。ドナーは義兄で血液型不適合。CDCは陰性だが、フローサイトメトリーXMでT、Bともに陽性の症例である。DSAに関してはClass1 抗HLA抗体が陽性。また妊娠歴や輸血歴を反映してその他の抗HLA抗体(non DSA)を多数認めた。本症例はクレアチニン0.8 mg/dL程度と腎機能良好で推移したが、移植後3ヵ月時の腎生検で急性AMRを認め、またg2、ptc1とMVIスコア陽性となったことから、IVIg 50g(1g/kg)を2回投与した。
本症例は最近のものであり、移植後4ヵ月時には腎生検の結果が得られ、直ちにIVIg治療への移行が可能であった。今後、治療効果判定目的の腎生検を行い、AMRの推移をみていきたいと考えている。
4. 効能又は効果
下記の臓器移植における抗体関連型拒絶反応の治療
腎移植、肝移植、心移植、肺移植、膵移植、小腸移植
6. 用法及び用量
通常、人免疫グロブリンGとして、1日あたり1回1,000mg(10mL)/kg体重を2回点滴静注する。
ただし、患者の年齢及び状態に応じて適宜減量する、なお、必要に応じて追加投与する。
7. 用法及び用量に関連する注意
7. 9 本剤は投与開始から10日間以内を目安に2回の投与を完了するが、患者の年齢及び状態に応じて適宜調整すること。
移植腎長期生着時代においても、拒絶反応は依然、移植腎機能廃絶の主因となっている。Preformed DSA陽性症例などの高感作症例に対し、IVIgなどを含む脱感作療法による腎移植が可能となったが、移植後に高率にみられるAMRが問題となる。AMR治療ではIVIgやリツキシマブが保険適応になったが、慢性AMRでの治療奏効性は低い可能性があるため、早期の診断および治療介入が必要とされる。
開催日:2025年7月25日
会場:オンライン配信
主催:一般社団法人日本血液製剤機構
2026年2月掲載
審J2601236
【参考文献】
1) 日本移植学会: ファクトブック 2024 . https://www.asas.or.jp/jst/pdf/factbook/factbook2024.pdf (最終アクセス:2025年9月16日)
2) 日本臨床腎移植学会・日本移植学会: 移植 59: 217-36, 2024.
3) Briganti EM et al.: New Engl J Med 347: 103-9, 2002.
4) Sellarés J et al.: Am J Transplant 12: 388-99, 2012.
5) 日本移植学会: 臓器移植抗体陽性診療ガイドライン2018. メディカルレビュー社, 東京. 2018.
6) 日本移植学会: 臓器移植抗体陽性診療ガイドライン2023. ぱーそん書房, 東京. 2023.
7) Aubert O et al.: J Am Soc Nephrol 28: 1912-23, 2017.
8) Haas M et al.: Kidney Int 91: 729-37, 2017.
9) Velidedeoglu E et al.: Transplantation 102: e257-64, 2018.
10) Konvalinka A et al.: J Am Soc Nephrol 26: 1489-502, 2015.
11) Wiebe C, Am J Transplant 15: 2921-30, 2015.
12) Fotheringham J et al.: Transplantation 91:991-6, 2011.
13) de Kort H et al.: Am J Transplant 13: 485-92, 2013.
14) Ishida H et al.: Transpl Int 27: 371-82, 2014.
15) Unagami K et al.: Nephrol Dial Transplant 36: 1120-9, 2021.
16) Banno T et al.: Transpl Int 37: 11960, 2024.
17) Amrouche L et al.: Transplantation 101: 2440-8, 2017.
18) Marfo K et al.: Transplantation 98: 1082-8, 2014.
19) Okada D et al.: Transplant Int 31: 1008-17, 2018.
20) Maenosono R et al.: Int J Urol 31:422-9, 2024.
21) Ishihara H et al.: Transplantation 101: 1423-32, 2017.
22) Naesens M et al. Am J Transplant 24: 338-49, 2024.
23) Wan SS et al.: Transplantation 102: 557-68, 2018.
24) Böhmig GA, Transpl Int 32: 775-88, 2019.
25) Moreso F, Am J Transplant 18: 927-35, 2018.
26) 海上耕平ら: 日本臨床腎移植学会雑誌 8: 180-8, 2020.


